有機フッ素化合物およびフッ素ポリマーの分解・再資源化反応の開発ORGANOFLUORINE COMPOUNDS
1. 熱水反応による分解・無機化反応
2. 光化学反応による分解・無機化反応
※マウスカーソルを図の上に重ねると図のタイトルが表示されます。
熱水反応による分解・無機化反応
鉄粉+熱水を用いたPFAS類の還元分解
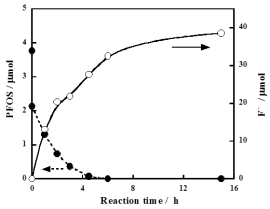
PFAS類は環境水中に存在する有機フッ素化合物の代表的なもので、生体蓄積性が特に問題となっているものがペルフルオロオクタンスルホン酸です。我々は水中のPFAS類を熱水(亜臨界水、超臨界水)で分解させることを検討しました。その結果、鉄粉を還元剤として用いると亜臨界水中で効果的に分解できることを見出しました。
反応は以下のようにして行いました。先ず、耐圧容器に不活性ガス雰囲気中でPFOS(カリウム塩)の水溶液(93~372 μM)と鉄粉もしくは他の金属粉(亜鉛、銅、アルミニウム)を入れ、250~350℃の亜臨界水の状態にしました。一定時間経過後、室温に戻して成分分析を行いました。比較のため金属粉を入れない場合についても実験を行いました。金属粉がない場合、水中のPFOS濃度はほとんど減少しませんでした。鉄粉を入れた場合にPFOSは最も迅速に分解しました。例えばPFOS初期濃度が372
μM、反応温度350℃、圧力23.3 MPaの場合、PFOSは6時間で水中から消失し、同時に水中にはフッ化物イオンが高収率で生成しました(右図)。この方法により電子産業界で使用されていた反射防止剤のPFOSや、炭素数2~6のPFAS類(ペルフルオロアルキル基の短いPFAS類はPFOS代替品として導入が進められている)の分解も可能でした。また、超臨界水状態にするとさらに反応は迅速に進行しました。
《関連論文》
H. Hori, Y. Nagaoka, A. Yamamoto, T. Sano, N. Yamashita, S. Taniyasu,
S. Kutsuna, I. Osaka, R. Arakawa, “Efficient decomposition of environmentally
persistent perfluorooctanesulfonate and related fluorochemicals using zerovalent
iron in subcritical water”, Environ. Sci. Technol, 2006, 40, 1049-1054. DOI: 10.1021/es0517419
H. Hori, Y. Nagaoka, T. Sano, S. Kutsuna, “Iron-induced decomposition of
perfluorohexanesulfonate in sub- and supercritical water”, Chemosphere,
2008, 70, 800-806. DOI: 10.1016/j.chemosphere.2007.07.015
フッ素系イオン交換膜の分解・無機化反応
フッ素系イオン交換膜の分解もPFOS分解と同様な方法で達成しました。フッ素系イオン交換膜(ポリマー)は造水、浄水、燃料電池、食塩電解等、様々な用途で用いられている機能性材料でありますが、その廃棄物は埋め立て処分されているのが現状で、分解処理方法は確立されていません。フッ素系イオン交換膜のうち、ペルフルオロアルキルエーテルスルホン酸を側鎖に持つペルフルオロスルホン酸膜(PFAS膜)については、過酸化水素水やフェントン試薬(Fe2+ + H2O2)による劣化過程を調べた例があります。しかし、それらは燃料電池の耐久性の向上を目的としたもので、廃棄物からフッ素成分を回収するために積極的に分解反応を探索した例はありませんでした。また、その劣化の過程においてPFCA/PFAS類似物質が生成するという報告もあるのでフッ化物イオンまで完全に無機化することが望まれます。そこで本研究ではPFAS膜について、金属粉を還元剤とした亜臨界水分解で無機化させることを試みました。
試料としては精製したNafion NRE-212を用いました。この膜(乾燥重量29.8 mg、総フッ素量1.03 mmol)と金属粉(9.60
mmol)、および純水(10 ml)を耐圧反応装置に入れ、アルゴン雰囲気下で密封後、250~350℃の亜臨界水状態にしました。一定時間経過後、室温に急冷し、水中およびガス相中の反応物を分析しました。
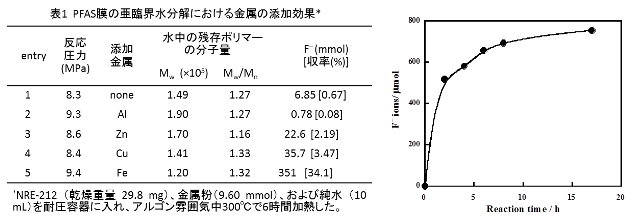
表1に300℃で6時間処理した場合の水中の残存ポリマー(水に溶解している)の分子量およびF-の生成量を示します。金属を添加しない場合、F-はほとんど生成しませんでした(entry 1)。アルミニウムを添加した場合、F-の生成は却って阻害されました。亜鉛、銅および鉄の場合には分解促進作用があり、鉄を用いた場合に特に顕著なF-の生成が見られ、その量は添加しない場合の51倍となりました(entry
5)。鉄粉を加えて反応温度を350℃に高めた場合、F-の生成量はさらに増加し、サイズ排除クロマトグラフィーではもはやポリマーのピークは検出されなくなりました。
上図右に350℃で鉄粉を添加した場合のF-生成量の処理時間依存性を示します。17時間後にはF-の生成量は754 μmolに達しました。これは反応前の膜中のフッ素原子うち、73.2%がF-に変換されたことを意味し、ポリマーの側鎖のみならず、主鎖(CF2-CF2)xの部分まで効果的に分解できることが分かりました。
《関連論文》
H. Hori, M. Murayama, T. Sano, S. Kutsuna, “Decomposition of perfluorinated ion-exchange
membrane to fluoride ions using zerovalent metals in subcritical water”,
Ind. Eng. Chem. Res., 2010, 49 (2), 464-471. DOI: 10.1021/ie9004699
PFOS代替物質:PFAES類の分解
PFOS/PFOA代替物質としてペルフルオロアルキル基の中にエーテル結合を導入したものがあり、PFAES類はその一種です。PFAES類については酸素ガスを共存させた亜臨界水で効果的に分解できることが分かりました。
反応は耐圧容器にPFAES類(CnF2n+1OC2F4SO3-、n = 2, 3)の水溶液を入れ、酸素ガスを導入後密封して250~350℃の亜臨界水の状態にすることで行いました。比較のため、アルゴン雰囲気下での実験および対応するPFAS類として近年使用が増加しているペルフルオロブタンスルホン酸(C4F9SO3-、PFBS)を用いた実験も行いました。
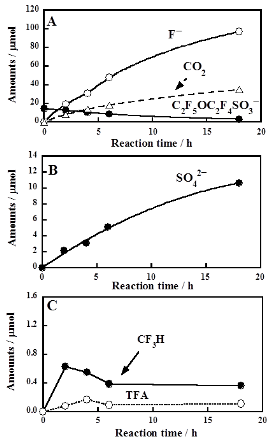 右図にC2F5OC2F4SO3-について酸素雰囲気下で反応(350℃)させた場合の分解の時間依存性を示します。水中のC2F5OC2F4SO3-の濃度は擬一次反応速度式に従って明白に減少し、F-、CO2(右図A)およびSO42-が生成しました(右図B)。さらに反応中間体として微量のトリフルオロ酢酸およびCF3Hが検出されました(右図C)。18時間後のF-の収率は73.8%であり、効果的に無機化が進行しています。またフッ素、炭素および硫黄に関する反応のマスバランスは97.2%、91.5%および94.6%と良好でした。
右図にC2F5OC2F4SO3-について酸素雰囲気下で反応(350℃)させた場合の分解の時間依存性を示します。水中のC2F5OC2F4SO3-の濃度は擬一次反応速度式に従って明白に減少し、F-、CO2(右図A)およびSO42-が生成しました(右図B)。さらに反応中間体として微量のトリフルオロ酢酸およびCF3Hが検出されました(右図C)。18時間後のF-の収率は73.8%であり、効果的に無機化が進行しています。またフッ素、炭素および硫黄に関する反応のマスバランスは97.2%、91.5%および94.6%と良好でした。
同じ反応条件においてC3F7OC2F4SO3-も効果的に無機化されました。その減少の擬一次反応速度定数はC2F5OC2F4SO3-の場合の1.6倍であり、この反応がペルフルオロアルキル基の長さに依存することが分かりました。一方この条件ではPFBSはほとんど分解しませんでした。PFBSの分解は上述のように鉄粉を還元剤とした亜臨界水反応でないと進行しません。
C2F5OC2F4SO3-の反応をアルゴン雰囲気下で行った場合、C2F5OC2F4SO3-の減少の時間依存性は酸素雰囲気下の場合とほぼ同じでしたが、生成物の分布が大きく変化しました。すなわちF-、CO2およびSO42-の生成量が大幅に減少する一方で、トリフルオロ酢酸およびCF3Hの生成量が増加しました。さらに新たな生成物としてHCF2SO3-が検出されました。このことは酸素ガスが反応中間体の無機化の促進に重要な役割を果たしていることを意味します。
《関連論文》
H. Hori, M. Murayama, S. Kutsuna, “Oxygen-induced efficient mineralization
of perfluoroalkylether sulfonates in subcritical water, Chemosphere, 2009, 77, 1400-1405.
DOI: 10.1016/j.chemosphere.2009.09.013
ペルオキソ二硫酸イオンを用いたPFCA類の温水分解
PFCA類はPFAS類と並んで環境中で懸念されている物質群であり、環境リスクが懸念されている典型例がペルフルオロオクタン酸(C7F15COOH、PFOA)です。我々はPFCA類を熱水反応で分解することを検討しました。その結果、S2O82-を添加した場合、意外にも80℃程度の低温の熱水、すなわち温水中で最も迅速にフッ化物イオンまで酸化分解できることを明らかにしました。
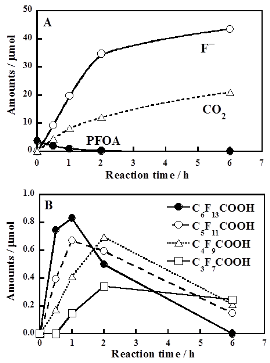 反応は耐圧容器に空気雰囲気中でPFCA類とS2O82-(カリウム塩)を入れ、密封・加熱することで行いました。右図にPFOAと134倍モル過剰のS2O82-を入れた温水(80℃)中におけるPFOA分解の時間依存性を示します。S2O82-を入れない場合にはPFOA濃度は全く減少しませんでしたが、S2O82-を入れた場合には迅速に減少し、同時に気相中にはCO2が、水中にはF-が生成しました(右図A)。6時間におけるF-およびCO2の収率(PFOA初期量中のフッ素量および炭素量に対する値)は77.5%および70.2%であり、効果的に無機化されていることが分かります。水中には微量の短鎖PFCA類も検出され(右図B)、時間の経過と共により短鎖な化学種の出現と消失が見られました。これはPFOA分解が長鎖種から短鎖種への逐次的な変換を経て進行していることを意味します。
反応は耐圧容器に空気雰囲気中でPFCA類とS2O82-(カリウム塩)を入れ、密封・加熱することで行いました。右図にPFOAと134倍モル過剰のS2O82-を入れた温水(80℃)中におけるPFOA分解の時間依存性を示します。S2O82-を入れない場合にはPFOA濃度は全く減少しませんでしたが、S2O82-を入れた場合には迅速に減少し、同時に気相中にはCO2が、水中にはF-が生成しました(右図A)。6時間におけるF-およびCO2の収率(PFOA初期量中のフッ素量および炭素量に対する値)は77.5%および70.2%であり、効果的に無機化されていることが分かります。水中には微量の短鎖PFCA類も検出され(右図B)、時間の経過と共により短鎖な化学種の出現と消失が見られました。これはPFOA分解が長鎖種から短鎖種への逐次的な変換を経て進行していることを意味します。
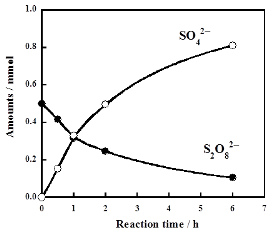
この反応はS2O82-の熱分解で生成した硫酸イオンラジカル(SO4・-)がPFOAを酸化することで進行するため、SO4・-は還元してSO42-になることが期待されます。実際、PFOA分解の進行に伴い水中のS2O82-濃度は減少し、SO42-が生成しました(右図下)。全ての反応時間において水中の硫黄の全モル数(SO42-のモル数+S2O82-のモル数×2)はS2O82-の初期モル数の2倍量と等しくなりました。このことは水中に安定に存在している硫黄化合物はS2O82-とSO42-のみであることを意味します。
 この方法を他のPFCA類さらにはPFCA類の代替物質として導入が進みつつあるあるペルフルオロエーテルカルボン酸類に適用したところ、PFOAの場合と同様にCO2とF-までの効果的な分解・無機化が観測されました。さらに迅速な分解を期待して反応温度を150℃に上昇させたところ、PFOAの減少速度は低下し、F-およびCO2の生成も大幅に減少しました(6時間における収率はそれぞれ24.6%および37.0%)。これは150℃のような高温ではSO4・-と水との反応が優先してPFOAとの反応が阻害されるためと考えられます。また、150℃では気相中に1H-ペルフルオロアルカン類(CnF2n+1H、 n = 4-7)も生成しました。以上のことからPFCA類をS2O82-により熱水分解させてF-を効果的に得るためには、意外にも80℃のような低温の熱水(温水)反応が望ましいことが分かりました。
この方法を他のPFCA類さらにはPFCA類の代替物質として導入が進みつつあるあるペルフルオロエーテルカルボン酸類に適用したところ、PFOAの場合と同様にCO2とF-までの効果的な分解・無機化が観測されました。さらに迅速な分解を期待して反応温度を150℃に上昇させたところ、PFOAの減少速度は低下し、F-およびCO2の生成も大幅に減少しました(6時間における収率はそれぞれ24.6%および37.0%)。これは150℃のような高温ではSO4・-と水との反応が優先してPFOAとの反応が阻害されるためと考えられます。また、150℃では気相中に1H-ペルフルオロアルカン類(CnF2n+1H、 n = 4-7)も生成しました。以上のことからPFCA類をS2O82-により熱水分解させてF-を効果的に得るためには、意外にも80℃のような低温の熱水(温水)反応が望ましいことが分かりました。
《関連論文》
H. Hori, Y. Nagaoka, M. Murayama, S. Kutsuna, “Efficient decomposition of perfluorocarboxylic acids and alternative fluorochemical surfactants in hot water”,
Environ. Sci. Technol., 2008, 42, 7438-7443. DOI: 10.1021/es800832p
PFOA代替物質:H-PFCA類の分解
H-PFCA類とはPFCA類の末端のトリフルオロメチル基のフッ素原子の1つを水素原子に置換したものです(一般式HCnF2nCOOH)。H-PFCA類は炭素・水素結合を有するためPFCA類よりは分解容易と推測されますが、これまで分解特性の報告は皆無でした。我々は上記の「S2O82-+温水分解法」をH-PFCA類(n
= 4-8)に適用し、PFCA類の場合と比較しました。
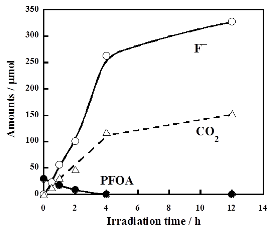
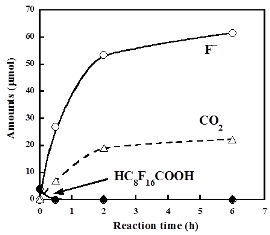 右図にHC8F16COOHの場合の反応の時間依存性を示します。ここでS2O82-はHC8F16COOHの初期量(濃度:392 μM)に対して128モル倍用いています。HC8F16COOHは30分で水中から消失しました。一方、F-の生成量は時間と共に増加し、6時間後にはその収率(HC8F16COOHの初期量中の総フッ素量を基準とした値)は98.2%に達し、事実上全てのフッ素成分がF-まで分解・無機化しました。S2O82-を添加しない場合、HC8F16COOHは6時間経過しても97.0%が残存し、F-の収率も0.02%と僅かでした。この結果はS2O82-から硫酸イオンラジカル(SO4・-)が発生し、それがHC8F16COOHの酸化分解を起こしていることを意味します。他のH-PFCA類の場合も同様にS2O82-を添加することで迅速に分解し、F-の収率は6時間で96.7~98.2%に達しました。80℃では分解が速すぎて速度論的な議論が難しいため反応温度を60℃に下げて実験を行いました。その場合でもH-PFCA類はS2O82-の共存下でF-まで明白に分解し、分解の初期速度は同じ条件におけるPFCA類の場合の7.1~12.7倍でした。
右図にHC8F16COOHの場合の反応の時間依存性を示します。ここでS2O82-はHC8F16COOHの初期量(濃度:392 μM)に対して128モル倍用いています。HC8F16COOHは30分で水中から消失しました。一方、F-の生成量は時間と共に増加し、6時間後にはその収率(HC8F16COOHの初期量中の総フッ素量を基準とした値)は98.2%に達し、事実上全てのフッ素成分がF-まで分解・無機化しました。S2O82-を添加しない場合、HC8F16COOHは6時間経過しても97.0%が残存し、F-の収率も0.02%と僅かでした。この結果はS2O82-から硫酸イオンラジカル(SO4・-)が発生し、それがHC8F16COOHの酸化分解を起こしていることを意味します。他のH-PFCA類の場合も同様にS2O82-を添加することで迅速に分解し、F-の収率は6時間で96.7~98.2%に達しました。80℃では分解が速すぎて速度論的な議論が難しいため反応温度を60℃に下げて実験を行いました。その場合でもH-PFCA類はS2O82-の共存下でF-まで明白に分解し、分解の初期速度は同じ条件におけるPFCA類の場合の7.1~12.7倍でした。
PFCA類との違いは速度だけでなく、反応の機構にも表れました。反応液のESI-MSスペクトルを測定したところ、PFCA類では出発物質よりもペルフルオロアルキル基が短くなったPFCA類(短鎖PFCA類)が中間体として検出されました。その場合、時間の経過と共に長鎖種が消失し、さらに短鎖なPFCA類が現れました。このことはPFCA類では分子末端のカルボキシル基が外れることから分解が進行することを意味します。一方H-PFCA類においては反応途中で出発物質よりもペルフルオロアルキル基が短くなったH-PFCA類は検出されず、代わりに短鎖ペルフルオロジカルボン酸類(一般式HOOCCnF2nCOOH)が現れました。このことはH-PFCA類ではSO4・-が末端の水素原子が結合している炭素原子に対して求核置換反応を起こすことで反応が開始される、つまりカルボキシル基と反対側の末端から反応が起こることを意味します。生成したペルフルオロジカルボン酸はPFCA類の場合と同様に、末端のカルボキシル基の脱炭酸により分解が進むと考えられます。
《関連論文》
H. Hori, M. Murayama, N. Inoue, K. Ishida, S. Kutsuna, “Efficient mineralization of hydroperfluorocarboxylic acids with persulfate in hot water”,
Catal. Today, 2010, 151 (1-2), 131-136. DOI: 10.1016/j.cattod.2010.02.023
光化学反応による分解・無機化反応
ヘテロポリ酸を用いたPFCA類の光触媒分解
水中のPFCA類はOHラジカルとの反応性が極めて低いため酸化チタン光触媒ではほとんど分解できませんが、我々はヘテロポリ酸光触媒[PW12O40]3-を用いることでフッ化物イオンと二酸化炭素まで完全に分解させることに成功しました。これはPFCA類に関して光触媒で分解させることに成功した世界初の例です。[PW12O40]3-は高い酸化力、強酸性下で安定(pHが
1以下でも安定なため分解対象物がPFCA類のような強酸類であっても使用できる)、均一系触媒なのでコーキングを起こさない、回収・再利用可能(エーテルと特異的にアダクト形成して相分離する性質を利用して水中から回収できる)といった特徴があります。
 光反応は耐フッ素性の装置に炭素数2~9のPFCA類と[PW12O40]3-を含む水溶液を導入し、酸素雰囲気下で紫外・可視光を照射することで行いました。この方法により、例えばトリフルオロ酢酸(CF3COOH)の場合、1モルの消失に対して2モルの二酸化炭素と3モルのフッ化物イオンが生成したので物質収支も合っていました。また、テトラフルオロメタン(CF4)等の環境に有害な物質が発生しないことも確認しました。PFOAの場合、反応初期には水中に炭素数が少ないPFCA類(短鎖PFCA類)も検出されましたが、長時間照射によりこのような中間体は消失し、フッ素成分はフッ化物イオン、炭素成分は二酸化炭素まで分解しました(右図)。この反応は光励起した[PW12O40]3-がPFCA類から電子を奪うことで開始されますが、それに伴い[PW12O40]3-は1電子還元した状態、すなわち[PW12O40]4-になります。この還元種が系内に存在する酸素と反応して元の[PW12O40]3-の状態に戻ることで触媒サイクルが形成されています。
光反応は耐フッ素性の装置に炭素数2~9のPFCA類と[PW12O40]3-を含む水溶液を導入し、酸素雰囲気下で紫外・可視光を照射することで行いました。この方法により、例えばトリフルオロ酢酸(CF3COOH)の場合、1モルの消失に対して2モルの二酸化炭素と3モルのフッ化物イオンが生成したので物質収支も合っていました。また、テトラフルオロメタン(CF4)等の環境に有害な物質が発生しないことも確認しました。PFOAの場合、反応初期には水中に炭素数が少ないPFCA類(短鎖PFCA類)も検出されましたが、長時間照射によりこのような中間体は消失し、フッ素成分はフッ化物イオン、炭素成分は二酸化炭素まで分解しました(右図)。この反応は光励起した[PW12O40]3-がPFCA類から電子を奪うことで開始されますが、それに伴い[PW12O40]3-は1電子還元した状態、すなわち[PW12O40]4-になります。この還元種が系内に存在する酸素と反応して元の[PW12O40]3-の状態に戻ることで触媒サイクルが形成されています。
《関連論文》
H. Hori, E. Hayakawa, H. Einaga, S. Kutsuna, K. Koike, T. Ibusuki,
H. Kitagawa, R. Arakawa, “Decomposition of Environmentally persistent perfluorooctanoic
acid in water by photochemical approaches”, Environ. Sci. Technol, 2004,
38, 6118-6124. DOI: 10.1021/es049719n
ペルオキソ二硫酸イオンを用いたPFCA類の光酸化分解
上述の方法では200Wの水銀・キセノン灯を使用した場合、1.35 mMのPFOAを完全に消失させるのに24時間を要します。我々は、より短時間でPFCA類を分解するためにペルオキソ二硫酸イオン(過硫酸イオン、S2O82-)を光酸化剤として用いる方法を開発しました。
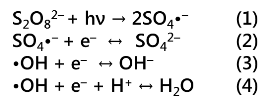 水中のS2O82-に紫外光を照射すると酸化力が非常に強い硫酸イオンラジカル(SO4・-)が生成します(右1式)。SO4・-生成の量子収率は2で非常に効率が高いです。発生したSO4・-の酸化還元電位(2式の反応に相当)は水中で2.5~3.1
Vであり、OHラジカル(3式の場合は1.8 V、4式では2.7 V)と同程度か、それ以上です。
水中のS2O82-に紫外光を照射すると酸化力が非常に強い硫酸イオンラジカル(SO4・-)が生成します(右1式)。SO4・-生成の量子収率は2で非常に効率が高いです。発生したSO4・-の酸化還元電位(2式の反応に相当)は水中で2.5~3.1
Vであり、OHラジカル(3式の場合は1.8 V、4式では2.7 V)と同程度か、それ以上です。
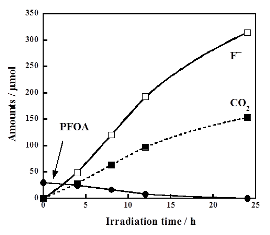
 そこでPFOA水溶液にS2O82-を添加し、光照射してSO4・-を生成させることでPFOAの分解を試みたところ、[PW12O40]3-を使用した場合と同じ条件において4時間で消失させることができました(右図、PFOAの消失後も中間体の短鎖PFCA類の分解が続くためF-とCO2の生成は続いています)。また、SO4・-は反応後には硫酸イオンになりますが、その生成量は使用したS2O82-の2倍モルとなりました。つまり硫黄分は全て硫酸イオンとして回収可能です。硫酸イオンの処理はカルシウム添加やイオン交換等の確立された方法を用いることができます。この反応は触媒反応ではないためS2O82-は消費される一方で再利用はでませんが、硫黄化合物は安価であること、反応速度が大きいこと、副生成物は硫酸イオンという処理しやすいものであることは大きな利点です。
そこでPFOA水溶液にS2O82-を添加し、光照射してSO4・-を生成させることでPFOAの分解を試みたところ、[PW12O40]3-を使用した場合と同じ条件において4時間で消失させることができました(右図、PFOAの消失後も中間体の短鎖PFCA類の分解が続くためF-とCO2の生成は続いています)。また、SO4・-は反応後には硫酸イオンになりますが、その生成量は使用したS2O82-の2倍モルとなりました。つまり硫黄分は全て硫酸イオンとして回収可能です。硫酸イオンの処理はカルシウム添加やイオン交換等の確立された方法を用いることができます。この反応は触媒反応ではないためS2O82-は消費される一方で再利用はでませんが、硫黄化合物は安価であること、反応速度が大きいこと、副生成物は硫酸イオンという処理しやすいものであることは大きな利点です。
我々はこの方法を用いてワックス廃液中のPFCA類や、PFCA類よりも有害性が懸念されるフルオロテロマー不飽和カルボン酸類(CnF2n+1CF=CHCOOH)の分解にも成功しています。PFOAよりも炭素数が2つ以上多いPFCA類(PFDA、PFUA)は水中では溶解度が低いため懸濁状となり、コロイド粒子が光を散乱するため光反応が難しくなりますが、このような長鎖PFCA類については液体二酸化炭素に特異的に溶解する性質を利用して液体二酸化炭素・水の二相混合系でペルオキソ二硫酸イオンを使用することでフッ化物イオンまで効果的に光分解させることができました。
《関連論文》
H. Hori, A. Yamamoto, E. Hayakawa, S.Taniyasu, N. Yamashita, S. Kutsuna,
H. Kitagawa, R. Arakawa, “Efficient decomposition of environmentally persistent
perfluorocarboxylic acids using persulfate as a photochemical oxidant”
Environ. Sci. Technol, 2005, 39, 2383-2388. DOI: 10.1021/es0484754
H. Hori, A. Yamamoto, S. Kutsuna, “Efficient photochemical decomposition
of long-chain perfluorocarboxylic acids by means of an aqueous/liquid CO2 biphasic system”, Environ. Sci. Technol, 2005, 39, 7692-7697. DOI: 10.1021/es050753r
H. Hori, A. Yamamoto, K. Koike, S. Kutsuna, I. Osaka, R. Arakawa, “Persulfate-induced
photochemical decomposition of a fluorotelomer unsaturated carboxylic acid
in water”, Water Res, 2007, 41, 2962-2968. DOI: 10.1016/j.waters.2007.02.033
ケイ素系ヘテロポリ酸を用いた新規フッ素系界面活性剤の光触媒分解
上記のように、リン系ヘテロポリ酸光触媒H3PW12O40はPFCA類をF-およびCO2まで効率的に分解できます。しかし、強酸性下(pH<2)でないと使用できません。また、有機フッ素化合物に限らずヘテロポリ酸光触媒を用いた有機物の酸化分解の報告例はH3PW12O40に集中しています。そこで我々はより広いpH領域でも安定な、ケイ素系ヘテロポリ酸H4SiW12O40を用い、PFCA類の代替物質として使用が拡大しつつあるヒドロペルフルオロカルボン酸類(H-PFCA類、HCnF2nCOOH、n=4, 6)の分解を試みました。
その結果、H-PFCA類はF-およびCO2まで分解できること(右図)、その触媒活性は強酸性からpH5.2までの広いpH領域において維持されること、分解はH-PFCA分子末端のω-H原子の脱離から開始され、両端がカルボキシル基のペルフルオロジカルボン酸(HOOCCn-1F2n-2COOH)を経て進行すること、基質減少の擬一次反応速度定数は対応するPFCA類の1.8~2.5倍に達すること等を明らかにしました。
《関連論文》
H. Hori, K. Ishida, N. Inoue, K. Koike, S. Kutsuna, “Photocatalytic mineralization
of hydroperfluorocarboxylic acids with heteropolyacid H4SiW12O40 in water”, Chemosphere, 2011, 82(8), 1129-1134. DOI: 10.1016/j.chemosphere.2010.11.038
酸化タングステンとペルオキソ二硫酸イオンを用いたFTUCA類の可視光分解反応
2000年代の中頃から、PFCA類の関連物質であるフルオロテロマー不飽和カルボン酸類(FTUCA類、CnF2n+1CF=CHCOOH)が環境中で検出されています。FTUCA類はPFCA類よりも有毒性が高いことやフッ素化アルコール類を含む排水の活性汚泥処理プロセスから生成することなどが報告されています。そのため、これらを穏和な条件で無害な化学種まで分解する技術が必要とされています。そこで我々は典型的なFTUCAであるC3F7CF=CHCOOHについて、酸化タングステン光触媒を用いて可視光照射で分解させることを試みました。
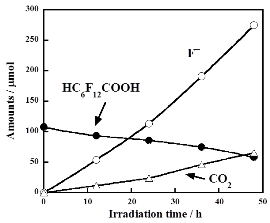
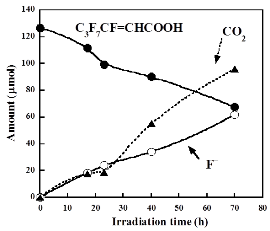 その結果、Ar雰囲気で電子アクセプタであるS2O82-を共存させることで効果的に分解できることを見出しました。酸素雰囲気でTiO2(P25)またはWO3のどちらかのみで反応させたとき、C3F7CF=CHCOOHは分解しませんでした。さらに、WO3とH2O2を組み合わせた場合もC3F7CF=CHCOOHほとんど分解しませんでした。一方で、WO3とペルオキソ二硫酸(カリウム塩)の組み合わせはC3F7CF=CHCOOHをF-、CO2、C3F7COOH、C2F5COOHまで効果的に分解しました(右図)。アルゴン雰囲気でWO3とペルオキソ二硫酸の組み合わせで反応を行うとより効果的に分解しました。これは酸素雰囲気の場合、溶液中に過酸化水素がアルゴンの場合よりも一桁多く生成し、これがペルオキソ二硫酸イオンや硫酸イオンラジカルを消費するため、C3F7CF=CHCOOHの分解反応が抑制されたためであることが分かりました。
その結果、Ar雰囲気で電子アクセプタであるS2O82-を共存させることで効果的に分解できることを見出しました。酸素雰囲気でTiO2(P25)またはWO3のどちらかのみで反応させたとき、C3F7CF=CHCOOHは分解しませんでした。さらに、WO3とH2O2を組み合わせた場合もC3F7CF=CHCOOHほとんど分解しませんでした。一方で、WO3とペルオキソ二硫酸(カリウム塩)の組み合わせはC3F7CF=CHCOOHをF-、CO2、C3F7COOH、C2F5COOHまで効果的に分解しました(右図)。アルゴン雰囲気でWO3とペルオキソ二硫酸の組み合わせで反応を行うとより効果的に分解しました。これは酸素雰囲気の場合、溶液中に過酸化水素がアルゴンの場合よりも一桁多く生成し、これがペルオキソ二硫酸イオンや硫酸イオンラジカルを消費するため、C3F7CF=CHCOOHの分解反応が抑制されたためであることが分かりました。
《関連論文》
H. Hori, A. Ishiguro, K. Nakajima, T. Sano, S. Kutsuna , K. Koike, “Visible
light-induced decomposition of a fluorotelomer unsaturated carboxylic acid
in water with a combination of tungsten trioxide and persulfate”, Chemosphere, 2013, 93 (11), 2657-2922. DOI: 10.1016/j.chemosphere.2013.09.024
空気中フルオロテロマーアルコールの光触媒分解
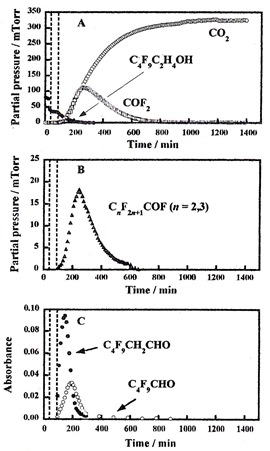
環境中のPFCA類やPFAS類の起源としては、これらの物質が製造や使用の際に放出されるだけでなく、別の有機フッ素化合物が環境中でこれらに変換されるという間接発生源の存在が指摘されています。その代表的なものにフルオロテロマーアルコール類(FTOH類)があり、揮発性のFTOH類が大気中に放出されてPFCA類になると考えられています。そこで我々はその発生源対策のために空気中のC4F9C2H4OHについて酸化チタン光触媒による分解挙動を調べました。
右図にその分解の様子を示します。空気中のC4F9C2H4OHは酸化チタンの光触媒作用によりC4F9CH2CHOやC4F9CHO(右図C)、次にCnF2n+1COF(右図B)、さらにCOF2(右図A)を経て二酸化酸素になります。
また、フッ素成分は光電子分光測定により二酸化チタン表面で最終的にフッ化物になることが分かりました。中間体として検出されたCOF2は有害ですが、容易に加水分解して二酸化炭素とフッ化水素酸になることが知られています。したがってこの方法を排ガス等に応用する際には、反応装置にガスと水を接触させるバブラーを連絡する等の工夫をすればよいのです。空気中の相対湿度を増加させると反応中間体の分解が促進して二酸化炭素とフッ化物イオンの生成が増加したため、空気の湿度が反応の重要なファクターであることも分かりました。
《関連論文》
S. Kutsuna, Y. Nagaoka, K. Takeuchi, H. Hori, “TiO2-induced heterogeneous photodegradation of a fluorotelomer alcohol in air”, Environ. Sci. Technol, 2006, 40, 6824-6829. DOI: 10.1021/es060852k
バナースペース
堀 久男研究室
〒259-1293
神奈川県平塚市土屋2946
神奈川大学湘南ひらつかキャンパス 6号館106室
TEL 0463-59-4111(代表)
Mail h-hori[a]kanagawa-u.ac.jp