亜臨界・超臨界水とはSUBCRITICAL AND SUPERCRITICAL WATER
我々の研究で用いている亜臨界水と超臨界水について簡単に説明します。
超臨界水や亜臨界水についてより詳しく知りたい人は以下の文献を参考にしてください。
≪参考文献≫
岩波書店編集部編『いま、この研究がおもしろい』、岩波書店、pp.91-108、2005
川瀬義矩著『水の役割と機能化』、工業調査会、pp.64-67、2007
吉田弘之監『亜臨界水反応による廃棄物処理と資源・エネルギー化《普及版》』、シーエムシー出版、pp.3-5、2012
佐古猛ら著『超臨界流体のはなし』、日刊工業新聞社、pp.18-119、2006
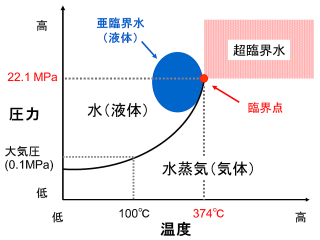
物質は温度や圧力の変化により、分子間相互作用と運動エネルギーの兼ね合いから、固体・液体・気体と状態を変化させます。水の状態図を左に示します(正しいスケールではありません)。気液共存線の終点が臨界点(374 ℃、22.1 MPa)であり、この温度・圧力以上の状態の水を超臨界水と呼びます。臨界点よりもやや低い領域にある高温、高圧の水(液体)が亜臨界水です。亜臨界水や超臨界水は無極性の有機化合物を溶解したり、加水分解したりする等、普通の水にはない性質を持っています。
1) 超臨界水
超臨界水がこのような特異な性質を持つ理由は、超臨界水が液体の水と気体の水蒸気の両方の性質を併せ持っている流体であるからです。超臨界状態の水は分子が激しく動き回り、分子の塊(クラスター)が集合・離散を繰り返しています。構成分子は、均一に分布しているのではなく、液体に近い分布の密な領域と気体に近い疎の領域からなっており、不均一な「ゆらぎ」が生じます。このゆらぎが超臨界水の特異性を支配している基本的な因子であると考えられています。
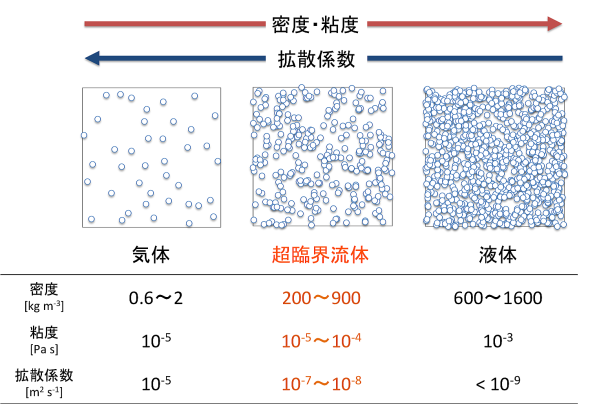
上図に水の状態のイメージと物性値を示します。超臨界水の密度は液体の1/10~1/2程度であり、水蒸気に比べて数百倍大きくなります。粘度は水蒸気程度に低く、拡散係数は液体と気体の中間となっています。
さらに、超臨界水では誘電率が低下し、極性が低い有機化合物を溶解します。誘電率とは溶媒の極性を表す尺度で、値が大きいほど高極性となり、イオン性の物質を良く溶かします。通常の水の誘電率は80程度と大きいため、誘電率の低い炭化水素は溶解しませんが、超臨界水の誘電率は2~10程度で誘電率の低い有機物(ヘキサン、ベンゼンなど)を溶解することができます。そのため超臨界水中では、これらの有機物と酸素などの酸化剤が均一相を形成します。
2) 亜臨界水
亜臨界水の特徴は高いイオン積(Kw = [H+][OH-])を持つことです。イオン積とは、純水がどの程度水素イオンH+と水酸化物イオンOH-に解離しているかを示す尺度です。常温常圧の水のイオン積は10-14(mol/kg)2ですが、温度・圧力が高くなるとイオン積は増大し、250~300℃付近の高温高圧の液体では約1000倍の10-11 (mol/kg)2となります。このときのH+とOH-イオン濃度は室温の水の約30倍となるため、それ自身が酸やアルカリ触媒の働きをして加水分解反応を促進します。
バナースペース
堀 久男研究室
〒259-1293
神奈川県平塚市土屋2946
神奈川大学湘南ひらつかキャンパス 6号館106室
TEL 0463-59-4111(代表)
Mail h-hori[a]kanagawa-u.ac.jp